ELISA によるコイ血清中からのKHV抗体測定法
水産研究・教育機構 水産技術研究所
1.序文
コイヘルペスウイルス(KHV*)病は1990年代後半にイスラエル・アメリカで確認されたのをかわきりにまたたく間に世界中に拡大した。日本では2003年茨城県霞ヶ浦においてKHV 病の発生が確認されて以降、養殖コイや天然河川・湖沼のコイに大きな被害をもたらした。現在日本では、KHV 病は「水産資源保護法」の輸入防疫対象疾病、ならびに「持続的養殖生産確保法」に規定された特定疾病に指定され、輸入ならびに国内の防疫が図られている。
KHV 病を発症したコイの群でも、KHV に対する免疫を獲得し感染耐過魚として生き残るものがいる。これら感染耐過魚の少なくとも一部はウイルスを保有しているため、それが新たな感染源となってKHV病を広げてしまうことが懸念されている。
現在、KHV 病の検査としては鰓や皮膚のPCR検査が一般的だが、この方法では発症中のコイからは検出できるものの、感染耐過魚からの検出は困難である。しかしながら、ウイルスを潜伏感染させている感染耐過魚は血液中に多量の抗KHV抗体を有すると考えられるので、理論的にはそれを検出することによって感染履歴を推定できると考えられる。
また、2006年国際獣疫事務局(OIE)が改変を行った「水産動物疾病診断マニュアル」にも新たにKHV病が追加され、錦鯉の輸出の際にも相手国側から抗体価の検査を求められることが多くなっている。
そこでここでは抗原抗体反応を利用したELISA(Enzyme-linked immuno solvent assay)によるコイ血清中のKHV抗体の測定方法を紹介する。測定にはアーク・リソース株式会社より販売されている試薬を使用しており、試薬名などは便宜上、販売されている商品名で記載しています。
* KHV ...... Koi Herpesvirus
2.測定原理
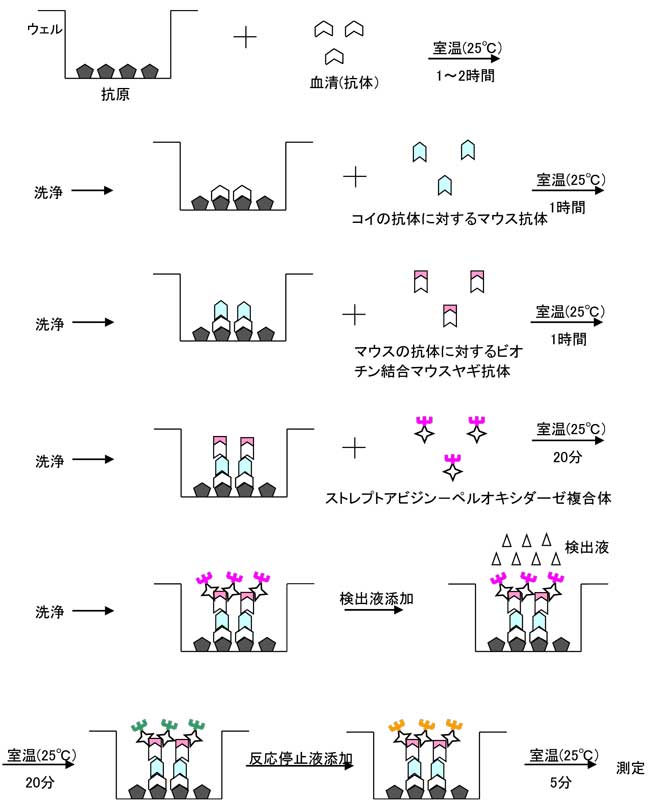
(1) 本法では抗原となるKHVを吸着させたプレート上のウェルと呼ばれる小さな反応槽にコイの血清を入れる。もし、血清中にKHVに対する抗体が存在すれば、その抗体はプレート上のKHVと結合する。
(2) 結合しない物質を洗浄により除去後、今度はコイの抗体に対するマウスの抗体を加え、コイの抗体に結合させる。
(3) さらに、このマウスの抗体に対するヤギの抗体を加えて結合させる。このヤギの抗体にはビオチンと呼ばれる物質が結合させてある。
(4) 次にストレプトアビジンという物質とペルオキシダーゼという酵素の複合体を加える。ストレプトアビジンはビオチンと強く結合する性質があるため、この複合体はヤギ抗体上のビオチンと結合する。以上の操作により、結局血清中のKHVに対するコイの抗体がペルオキシダーゼで標識されることになる。実際には一つの分子に対して次の段階の分子が多数結合するため、このように多数のステップを踏むことで、最終的に一つのコイの抗体に対して非常に多くの酵素が結合することになり、反応が増強される。
(5) 酵素の基質を含む検出液を加えると、基質が酵素反応により発色するので、硫酸により反応を停止させた後、吸光度の測定を行う。
得られた血清の吸光度を標準試薬の吸光度と比較して結果を判断する。
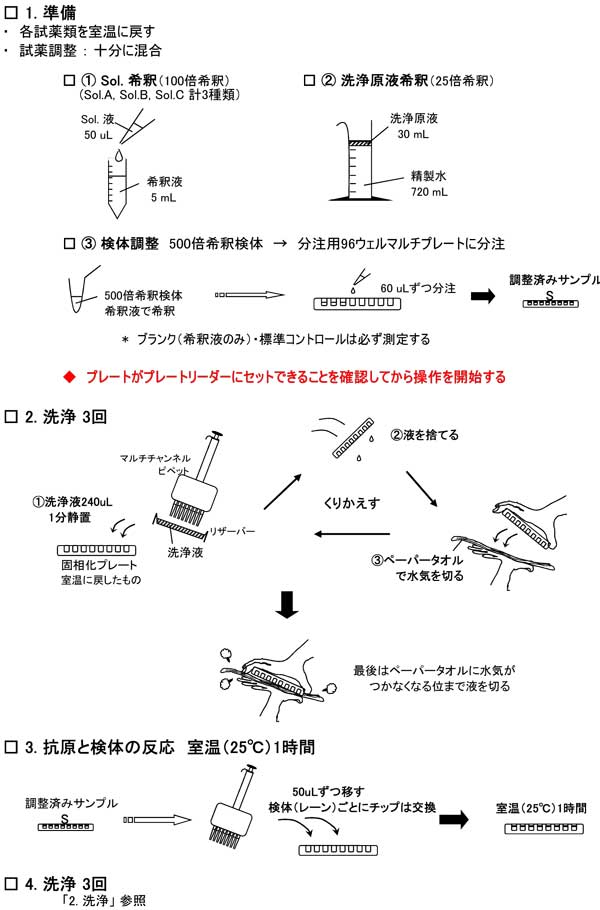
3.測定準備
3-1.試薬調整 : 十分に混和する
| 容器番号 | 試薬名注) | 調整法 | 調整試薬名 |
|---|---|---|---|
| 1. 2. 3. |
Sol. A Sol. B Sol. C |
希釈液で100倍に希釈します 50ul Sol. + 5ml 希釈液 (1バイアルで96ウェル分です) |
Sol. 1 Sol. 2 Sol. 3 |
| 8. | 洗浄原液 | 洗浄原液は十分に混和後、精製水で25倍に希釈します 原液 30ml + 精製水 720ml |
洗浄液 |
注 ) アーク・リソース株式会社より販売されている試薬名
3-2.検体調整・分注
コイ血清を希釈液で500倍に希釈し、十分に混合する。
測定誤差やエラーを考え、1検体を最低3個のウェルで測定する。
なお、500倍希釈検体は1ウェルあたり50uL必要。
分注用96ウェルアッセイプレートを使用すると検体の分注操作を簡便で迅速に行える。特にサンプル数が多い場合はプレートの乾燥を防ぐためにも分注用のプレートを用いた方がよい。その際はロスを考慮し1ウェルあたり60uL調整しておく。
- 検体のコイ血清を500倍希釈し、十分に混合する。
例:コイ血清 5uL + 希釈液 95uL(20倍希釈)
→20倍希釈血清 8uL + 希釈液 192uL(終濃度500倍希釈) - 500倍希釈した検体を、まず分注用96ウェルアッセイプレートに1ウェルあたり60uLずつ(もしくは3重測定分180uL)分注する。ブランクには希釈液のみを使用する。
ブランク(BL)・標準コントロールは必ず測定する。 (標準コントロールは希釈せず、そのまま使用する。)
4.測定方法
このプロトコールは全96ウェルを使用した場合の方法。 液の分注には、8連のマルチチャンネルピペットを使用すると便利。
ステップ 1-1: 固相化プレートを室温に戻す
* 固相化プレートは必ず室温に戻してから操作を開始する。
* Sol.A, Sol.B, Sol.C, は使用するまで冷蔵(もしくは氷上)保管しておく。
ステップ 1-2: 試薬溶液の準備および検体希釈
「3. 測定準備」参照
* 操作前に、プレートがプレートリーダーにセットできることを確認する。 プレートリーダーによってはそのままでは装着できない場合があるので注意。
ステップ 2: 固相化プレートの洗浄
室温に戻した固相化プレートを,あらかじめ調製しておいた洗浄液で3回洗浄し,洗浄後は完全に液を取り除く。
リザーバーに洗浄液を入れ、マルチチャンネルピペットですべてのウェルに240uL(120uLx2回)ずつ入れる。そのまま1~2分静置し、プレートを裏返しにして液を捨てる。この操作を3回繰り返す。
* ELISAプレートウォッシャーを使用する場合はそれぞれの機械のマニュアルを参照すること。
洗浄が終わったプレートは、最後に裏返しにしてペーパータオルなどの上にたたきつけ、ペーパーに水気がつかなくなる位まで液を切る。
注 ) :洗浄液が残っていると測定値に影響を与えるので、検体を入れる前のプレートは完全に液を除くことが大切。
ステップ 3: 抗原と検体の反応
500倍希釈した検体を1ウェル50uLずつ入れる。 分注後、室温(25℃)で1時間反応させる。
注 ) : 検体(レーン)ごとに必ずチップを取り替え、異なる検体が決して混ざらないようにする。
また、反応温度が大きく異なる場合、測定値に影響を与える可能性がある。
室温で構わないが、気温の高低には注意する。
ステップ 4: 洗浄
反応液を捨て、ステップ 2. と同様に3回洗浄する。
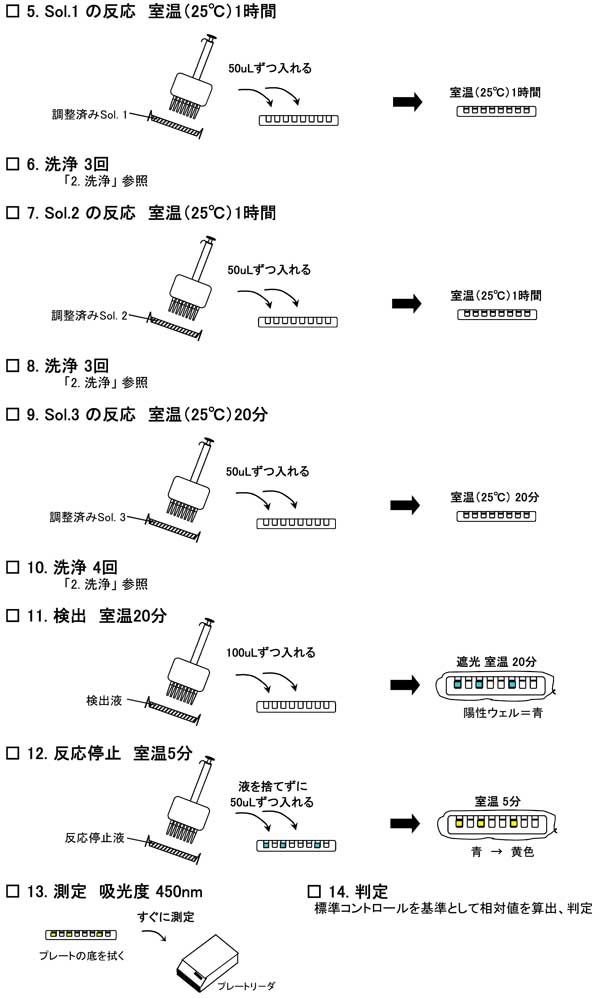
ステップ 5: Sol. 1(抗コイ抗体) との反応
リザーバーに調整しておいたSol. 1 の液を入れ、全てのウェルに50uLずつ分注する。
ステップ 6: 洗浄
反応液を捨て、ステップ 2. と同様に3回洗浄する。
ステップ 7: Sol. 2(ビオチン化抗体) との反応
リザーバーに,調整しておいたSol. 2 の液を入れ、全てのウェルに50uLずつ入れる。 分注後、室温(25℃)で1時間反応させる。
ステップ 8: 洗浄
反応液を捨て、ステップ 2. と同様に3回洗浄する。
ステップ 9: Sol. 3(ペルオキシダーゼ標識物) との反応
リザーバーに,調整しておいたSol. 3 の液を入れ、全てのウェルに50uLずつ入れる。 分注後、室温(25℃)で20分反応させる。
ステップ 10: 洗浄
反応液を捨て、ステップ 2. と同様に4回洗浄する。
ステップ 11: 検出液 との反応
リザーバーに検出液を入れ、全てのウェルに100uLずつ分注する。アルミ ホイルなどで遮光して、室温で正確に20分反応させる。
注 ) :陽性の場合、青く発色する。
ステップ 12: 反応停止
リザーバーに反応停止液を入れ、検出液は捨てないまま全てのウェルに50uLずつ投入し、反応を停止させる。この時、反応液が攪拌されるように少し強めに分注する。
注 ) :青い発色が黄色に変化する。
ステップ 13: 測定
反応停止液を入れてから5分後、すぐにプレートリーダーで450nmの吸光度を測定する。
注 ) :反応停止後、測定までに時間が経つと吸光度が変化してきます。
長時間放置すると正確な測定ができなくなるので注意する。
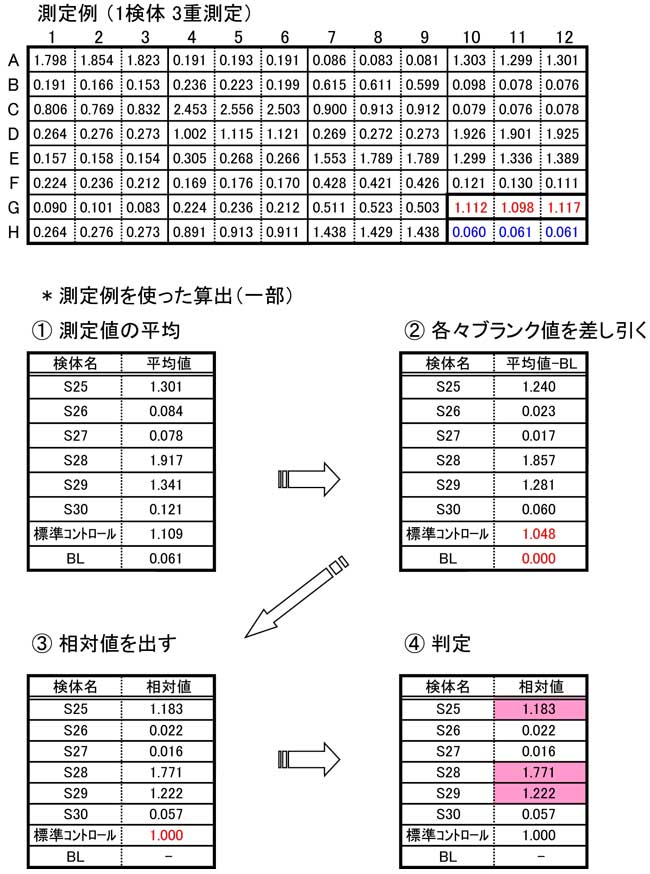
ステップ 14: 判定 (標準コントロールに対する相対値を算出)
結果は標準コントロールを基準として相対値を算出する。
* 算出方法
- 標準コントロールとブランクを含めたすべてのサンプルの3重測定の値を平均する。
- 各々平均した測定吸光度の値からブランクの値を差し引く。この時、 標準コントロールの値(ブランクを差し引いた値)が0.4以下となった場合は正しい判定が出来ないので注意。
- 標準コントロールの値を「1」として検体の相対値を算出する。
- 結果はグループとして総合的に判断します。ただし1個体のみでも相対値が高い値を示した場合、そのグループはKHV病の感染履歴を疑う必要がある。
結果については次項「判定の注意点」を参照のこと。
判定の注意点:重要
抗KHV抗体価測定ELISAによる結果の解釈について
本測定法はウェルに固相化されたコイヘルペスウイルス(KHV)に結合するコイの血中の抗体量を測定するものです。KHVに感染・発症し,治癒したコイは血液中にKHVに対する抗体を持つようになりますから,そのようなコイは本法で高い抗体価を示します。本法によりKHV病を診断することはできません。しかし,PCRでは感染耐過魚の保有するKHVを検出できない場合があり,そのようなときに,血清中の抗体価を測定し,その魚群のKHV病の感染履歴を推定することができます。しかし,以下のような点に注意が必要です。
- 水温低下期に感染し,そのまま低水温で推移した場合,抗体価が上昇しない可能性があります。また,20OC以上でも感染してから抗体価が上昇するまでは少なくとも10日程度かかりますので,それまでは抗体価は低いままです。
- また感染歴が無くとも比較的高い抗体価を示す場合があります。コイ(だけでなく脊椎動物一般に)の血中にはさまざまなものに対する抗体が存在します。また,固相化された丸ごとのKHVはさまざまな物質(抗原)を含んでいます。したがって,たとえ感染歴が無くとも,血液中にKHVのいずれかの部分に偶然少しでも結合してしまうような抗体が含まれていれば抗体価がその分高くなってしまいます。特に,KHVとよく似たCHV1)というウイルスがあり,このウイルスに対する抗体の一部はKHVにも高率で結合する場合があります(これは個体によって異なります)。したがって,KHVに感染したことがなくとも,CHVに感染したことがあるコイの血清は本法により高い値を示すことがあります。(しかし,だからといってCHVに感染経歴を持つコイがKHVに対する抵抗性を持つわけではありません。)
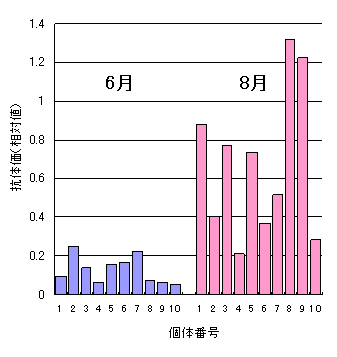
以上から明らかなように,本法では,ある値以上なら陽性,それ未満なら陰性,というはっきりした境界を定めることは原理的に不可能です。図をご覧ください。これは過去にKHV病が発生したある水系に,小さな生け簀を設置して,春にKHVに感染履歴の無いコイを入れ,6月(青)と8月(赤)に10尾ずつ取り上げて本法によって抗体価を測定した例を個体ごとに示したものです2)。 抗体価は標準血清に対する各検体の吸光度の相対値で表しています。試験の間,全く死亡はありませんでしたが,8月のサンプルでは全体的に抗体価が上昇しており,KHVに暴露されたことが伺えます。しかし,もしサンプルが8月のNo.7の1個体しかなかったら,この個体が感染歴を持つか否かを推定することは不可能です。 このように,本法は原則として群に適用すべきもので,複数のサンプルの測定結果を,水温など環境条件や群の飼育履歴,できればPCRの結果などとともに総合的に判断する必要があります。ただし,1個体のみの測定でも,標準血清の吸光度より高い値を示していれば当然KHVの感染歴を疑う必要があります。ただし,先に述べたような例外が存在するので注意する必要があります。特にその群がCHVに感染している場合は,本法でKHVの感染履歴を推定するのは困難です。
ところで,KHVに感染治癒した後,高い抗体価はいつまで持続するのでしょうか? 少なくとも実験感染魚においては高い抗体価は1年以上持続することがわかっていますが,それ以上については今のところデータがなく,何とも言えません。一方,魚をある抗原で刺激した場合,その抗原が無くなると,高い抗体価は一般的に数ヶ月程度しか持続しないとも言われています。このことはもしかするとKHV病が治癒してもKHVがコイの体のどこかに潜伏し続けていることを示しているのかもしれません。事実 実験感染後KHV病が感染治癒したコイでは, 1年後でも脳から高率にKHVが検出されています。
1) CHV: KHVと同じヘルペスウイルスの一種。コイ稚魚が感染すると高い死亡率をもたらす。生残魚には数ヶ月経過すると低水温下で高率に鰭や体表におできのような乳白色の腫瘍状病変が形成されるが,水温が上昇すると自然治癒する。
2) このデータは実際の測定例を元に,説明のために仮想的に作り上げたものです。
操作一覧
| ブランク | コントロール | 検体 | |
|---|---|---|---|
準備 |
* プレートリーダーへのプレート装着確認 |
||
| 洗浄 | 洗浄液 240uL x 3回 | ||
| 検体の分注 | 希釈液 50uL /well |
標準コントロール 50uL /well |
500倍希釈検体 50uL /well |
| インキュベート | 室温(25℃) 1時間 | ||
| 洗浄 | 洗浄液 240uL x 3回 | ||
| Sol. 1 分注 | 50uL /well | 50uL /well | 50uL /well |
| インキュベート | 室温(25℃) 1時間 | ||
| 洗浄 | 洗浄液 240uL x 3回 | ||
| Sol. 2 分注 | 50uL /well | 50uL /well | 50uL /well |
| インキュベート | 室温(25℃) 20分 | ||
| 洗浄 | 洗浄液 240uL x 3回 | ||
| Sol. 3 分注 | 50uL /well | 50uL /well | 50uL /well |
| インキュベート | 室温(25℃) 20分 | ||
| 洗浄 | 洗浄液 240uL x 4回 | ||
| 検出液 | 100uL /well | 100uL /well | 100uL /well |
| インキュベート | 室温 遮光 20分 | ||
| 反応停止液 | 50uL /well | 50uL /well | 50uL /well |
| 5分 | |||
| 測定 | 吸光度 450nm 測定 | ||
| 判定 | 標準コントロールを基準として相対値を算出、判定 | ||
使用試薬一覧
| 商品名注) | セット内容 | |
|---|---|---|
| 固相化プレート -KHV | 固相化プレート 標準コントロール液 分注用96ウェルアッセイプレート |
*固相化済プレート |
| コイ抗体セット(ELISA用) | Sol. A (抗コイ抗体) Sol. B (ビオチン化抗体) Sol. C (HRP標識物) |
* ペルオキシダーゼ標識物 |
| ELISAバッファーセット | 検出液 (TMB solution) 反応停止液 洗浄原液(x25) 希釈液 |
* 硫酸 * 25倍濃縮液 * 防腐剤含 |
注) アーク・リソース株式会社より販売。試薬購入の際は、同一の製造Lot.を購入し使用する。
操作に必要な器具類
| 名称 | 備考 |
|---|---|
| □ リザーバー | 反応液分注用 |
| □ 小型チューブ(例:1.5mL エッペン) | 検体調整用 |
| □ チューブ(例:15mL チューブ) | Sol. 希釈用。5mL以上調整可能なチューブ |
| □ メスシリンダー (例:1000mL 用) | 洗浄原液希釈用 |
| □ マルチチャンネルピペット | 50uLを正確に分注できるもの 10~300uL範囲の8連ピペットが便利。 |
| □ マイクロピペット:20uL , 200uL 用 | 検体調整用。校正されたピペット |
| □ 使い捨てピペットチップ | 専用チップ |
| □ プレートリーダー | 450nm の吸光度を測定可能なもの |
| □ ペーパータオル | 洗浄液ふき取り用 |
| △ 25℃設定のインキュベーター | 必須ではない。反応温度は測定値に影響を及ぼしますので25℃で反応させることを推奨する。 |
| △ ボルテックスミキサー | |
| △ ELISAプレートウォッシャー | 自動洗浄を行う場合(手間が大幅に軽減される) |
| △ 三角フラスコまたはビーカー |
フローシート(KHV抗体測定)
- 検体レイアウトシート(XLSX:13KB)


