病性鑑定指針
疾病名:コイヘルペスウイルス病(Koi herpesvirus disease;KHVD)
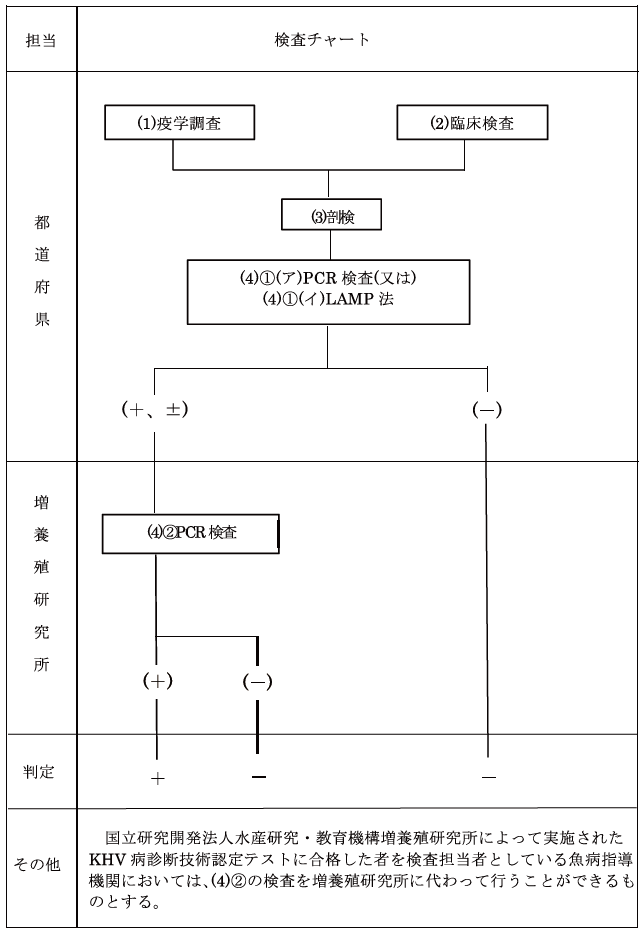
- 都道府県では、疫学調査、臨床検査、剖検を経て、PCR検査を行う。陽性であった場合は、水産研究・教育機構にサンプルが持ち込まれ、PCRによって確定診断が行われる。細胞培養によるウイルス培養を行う場合もある。
(1) 疫学調査
- 宿主域:マゴイ(Cyprinus carpio carpio)およびニシキゴイ(Cyprinus carpio koi)
- 発生地域:イスラエル、ヨーロッパ諸国、米国、インドネシア、タイ、フィリピン、台湾、日本
- 水温20~25℃程度で発生する。
- 当該魚は本病の発生が確認された地域から輸入された魚、あるいはその輸入された魚と接触したことがある魚である。
- 当該養魚場は過去に本病の発生が確認された地域からの魚、あるいはその魚と接触した魚を導入したことがある。
- 当該養魚場の飼育用水に,上記4.あるいは5.に関連した養魚場排水が混入する可能性がある。
(2) 臨床検査
- 行動観察:遊泳緩慢、平衡感覚失調などの遊泳異常が観察される。
- 外部病徴検査:最も特徴的な病変は、鰓の退色、びらん、巣状壊死、二次鰓弁の癒合である。その他、体表粘液過多、鰓基部のうっ血および出血、眼球の落ち込みなどが認められる。
- 体表組織の検鏡:鰓には、イクチオボドやトリコジナなどの原虫やカラムナリス菌などの細菌の二次感染がしばしば認められる。
(3) 剖検所見
- 特徴的な病変はないが、内臓の癒着がしばしば認められる。
(4) 診断法
1. 初動診断法
PCR検査
材料:鰓、腎臓および脾臓の抽出DNA
プライマー:KHV SphⅠ-5 F:5’-GAC-ACC-ACA-TCT-GCA-AGG-AG-3’
KHV SphⅠ-5 R:5’-GAC-ACA-TGT-TAC-AAT-GGT-CGC-3’
増幅産物サイズ:292bp
反応:94℃で30秒間、次いで94℃で30秒間、63℃で30秒間、72℃で30秒間を40サイクル、最後に72℃で7分間
LAMP法
材料:鰓、腎臓および脾臓の抽出DNA
プライマー:KHV-FIP:5’-CCC-AAA-CCC-AAG-AAG-CAG-AAA-CCC-GTT-GCC-TGT-AGC-ATA-GAA-GA-3’
KHV-BIP:5’-CAC-TCC-TCC-GAT-GGA-GTG-AAA-CTG-CCC-ATG-TGC-AAC-TTT-G-3’
KHV-F3:5’-CTG-TAT-GCC-CGA-GAG-TGC-3’
KHV-B3:5’-AAC-TCC-ATC-GCC-GTC-ATG-3’
KHV-LF:5’-CCC-GCC-GCC-GCA-3’
KHV-LB:5’-TGG-AAC-TGT-CTG-ATG-AGC-GT-3’
反応:65℃、60分間。
判定:反応液の白濁の有無を、濁度測定装置又は目視にて確認する。
2. 最終診断法:PCR検査
初動診断法のPCR法に加えて、次のPCRも実施
材料:鰓、腎臓および脾臓の抽出DNA
プライマー:KHV TK F:5’-GGG-TTA-CCT-GTA-CGA-G-3’
KHV TK R:5’-CAC-CCA-GTA-GAT-TAT-GC-3
増幅産物サイズ:409bp
反応:94℃で5分間、次いで95℃で1分間、55℃で1分間、72℃で1分間を40サイクル、最後に72℃で10分間。
(5) 病理組織学的所見
最も特徴的な変化は、鰓上皮細胞の増生、肥大および散在あるいは巣状の壊死である。鰓などの細胞中に核膜過染および弱好酸性の核内封入体が見られることがあるが、これをもって本病を診断することはできない。
(6) 類似疾病
本病は、鰓のびらん、壊死を伴い、患部に細菌、真菌および原虫の二次感染を認めることが多い。特にカラムナリス病と臨床検査で区別することが困難であり,しばしばカラムナリス菌との複合感染も認められる。成魚が高い斃死率を示し、病徴からも本病が疑われる場合にはPCRにより診断を行う。
(7) 消毒
1.用水・排水の殺菌
殺菌
紫外線4,000μW・sec/cm2
殺菌方法
- 15Wの紫外線ランプ一灯で、毎秒1Lの用水が殺菌可能である。
- 水路式の流水路を用い、上部に紫外線ランプを吊り下げる。
- 水深は5cm以下とし、紫外線ランプの中心から水路底までを10cmとする。
注意
- 紫外線ランプの寿命に注意し、早めに交換する。
- 濁った水やゴミ等の懸濁物があると殺菌が十分に行われないため、沈殿槽等で取り除く。
- 紫外線の透過をよくするため、水の表面を波立たせないように注意する。
- 紫外線が作業者の目に直接入らないようにする。
2.養殖池の消毒
消毒剤
有効塩素剤200ppm(高度サラシ粉、次亜塩素酸ナトリウム溶液)
消毒方法
- 消毒時間は30分~1時間。
- 水深を10cm~20cmまで落とし、上記の濃度になるように塩素剤を散布する。
- 固形の塩素剤の場合は、水に溶いて散布する。
- 池壁は、有効塩素濃度200ppmの消毒液をジョーロで満遍なく散布する。
注意
- 塩素系消毒剤は、皮膚刺激性、腐食性が強いため、消毒に際しては必ずマスク、手袋、メガネおよび合羽を着用し、薬剤が身体に付着しないようにする。
- 消毒の廃液を捨てる際には、必ずハイポで中和したのち、市販の塩素検出の水道水検査用キット等で残留塩素濃度を確認してから排水すること。
- 池消毒後の飼育用水には、地下水を直接注水すること。ウイルス汚染の可能性のある河川水や、既に魚を飼育した(している)池の水は使わない。
3.使用後の池水の消毒
消毒剤
有効塩素剤3ppm(高度サラシ粉、次亜塩素酸ナトリウム溶液)
消毒方法
- 消毒時間は30分~1時間。
- 上記の濃度になるように塩素剤を散布し、よく撹拌する。池水に含まれる有機物により塩素が消費されることを考慮し、塩素濃度が15ppmとなるように塩素剤を散布するとよい。
注意
- 塩素系消毒剤は、皮膚刺激性、腐食性が強いため、消毒に際しては必ずマスク、手袋、メガネおよび合羽を着用し、薬剤が身体に付着しないようにする。
- 消毒の廃液を捨てる際には、必ずハイポで中和したのち、市販の塩素検出の水道水検査用キット等で残留塩素濃度を確認してから排水すること。
4.飼育器具等の消毒
消毒剤
塩化ベンザルコニウム0.1%(逆性石けん)
有効塩素剤200ppm(高度サラシ粉、次亜塩素酸ナトリウム溶液)
消毒方法
- 器具等が十分に消毒剤に浸かるようにする。
- 消毒後の器具等は水洗いし、乾燥させておく。
注意
- 消毒剤は早めに交換する。
- 塩化ベンザルコニウムは手あかなどで汚れてきたら効果なし。
- 塩素系消毒剤は、臭いがなければ効果なし。
手指および小型の実験器具の消毒
消毒剤
塩化ベンザルコニウム0.1%(逆性石けん)
アルコール系消毒剤70%
消毒方法
- 手指・器具を十分に消毒槽に浸ける。
- 消毒後の器具等は水洗いし、乾燥させておく。
注意
- 消毒剤は早めに交換する。
- アルコールはスプレーで使用すると効果的である。
- 塩化ベンザルコニウムは手あかなどで汚れてきたら効果がなくなるため、早めの交換が必要。
(8)その他
なし。


