魚介類のための病理組織学の方法
感染制御グループでは魚病診断・研修センターに診断依頼が来たとき,協力して病理組織学的検査を行っている。その場合,通常は依頼者にサンプルを固定してもらう必要がある。ところが以下に述べるように,病理組織学的手法において最も重要なのはサンプルの固定であり,そこを専門家でない依頼者に行ってもらわなければならないというところに大きな問題が存在する。本論は,組織学の専門家でない方に病理組織学,特に養殖魚介類を診断する場合の病理組織学的方法の特徴と正しいサンプリング方法や固定方法を知っていただき,あわせて,魚介類の組織学を志す方々にも参考にしていただくことを目的として作成した。ただし魚介類であろうが,ヒトであろうが,パラフィン切片を用いた組織学の基本的な方法に違いがあるわけではない。したがって,ここでは一般的な組織学の方法については成書に譲り,魚介類の組織学,特に病理組織学的検査のためのサンプリングにあたり,注意しなければならない点に重点をおいて述べる。
組織学的方法(病理組織学)の一般的特徴
パラフィン切片による組織学は19世紀にはほぼ技術が確立し,現在まで基本的な部分はほとんど変わっていない。このように古い技術であるが,最先端の分子生物学の論文でも,例えば遺伝子操作した動物の組織を観察する場合などにいまだに組織学的方法は重要な役割を果たしている。臨床医学においては組織学的方法を用いた病理診断が日常的に行われている。組織学的方法の特徴は,他の生化学的方法に較べると情報量が多いということである。通常の生化学的検査では,一つの検査項目について通常一つの数値が出るだけであるが,組織学的方法では視覚的に様々な情報が得られる。また,感染症の診断において,分離不可能な病原体の場合,通常の細菌検査や培養細胞を用いたウイルス検査は無力であるが,組織学的にはこれらの分離不可能な病原体をとらえることが可能な場合がある。また,通常の微生物学的検査では,ある細菌やウイルスが検出されたからといって,必ずしもその微生物が病気(病変)の原因であるのか否か明らかでない場合が多いが,組織学的検査では微生物と病変の関係から,その微生物が病気の原因かどうか高い確度で推定できる。このような理由により,組織学的方法は新興感染症が頻繁に出現する水産動物の病理学において非常に重要なものとなっている。しかし一方,分離可能な微生物の場合,組織学的方法はPCRは言うに及ばず通常の微生物の分離方法に較べても検出感度が非常に低い。細菌が分離されても組織学的には全く細菌が観察できないことなどは日常的に生じる。もう一つの重要な特徴は,組織学的方法によって得られる情報の量や精度は検査する者の技量に大きく左右される,という点である。注意しなければいけないのは,切片を作って染色してプレパラートを作るということと,プレパラートを観察してそこから情報を読み取るということは全く別だということである。
組織学的方法における数量の重要性
上述のように,組織学的方法においては,情報の取得は観察者の技量にかかる部分が大きく,そのためしばしば,「組織学の結果は観察者のいうことをそのまま信じなければならない」とか,「数値化には意味がない」などという誤解をされることがある。ここでいう「数量」とは画像解析を行って算出する面積や体積のことではなく(それらが重要である場合もあるが),もっと単純な,「何尾を観察したか」とか「ある病変が観察したうちの何尾に見られたか」というようなものである。特に新興の疾病に関する研究はその後の診断の基礎になるものであり,このような「数量」に関する記述は重要である。しかし病理組織を記述した論文を見ると,検査した個体数や,その病変が観察された個体数などが記述していない場合も多く,記述あるいは実験手法が不十分な場合が多い(これは肉眼所見の記述にもいえる)。これは組織学の専門家の中にさえ,組織学は数量的記述(あるいは数量を考慮した実験計画)を行わなくてよい,という誤解,ないし甘えがあるからだと思われる。また,組織学的観察を行った時,ちょっと変わった病変や,あるいは特別重篤な例について詳しく記載したいという欲求が生じる。しかし新たな疾病を記述する場合において最も重要なのは多くの個体に普遍的に見られる病変である。ごく少数の個体のみに見られる変わった病変はもしかすると違った病因による可能性もある。また,水産動物では,臨床診断にあたっても「数量」はかなり重要である(下記)。
養殖水産動物の診断の特殊性
(1) 診断対象が個体ではなく群れであることが多い。したがって,複数尾を検査する必要がある(多い方がよいが病理組織検査では5 - 10尾程度)。
水産動物の診断の場合,特に食用に大量に養殖している動物を診断する場合は,ほとんどの場合特定の個体ではなくイケス(池)の群れ全体が診断対象となる。したがって診断には極力複数尾のサンプルを用いることが望ましい。
増養殖研究所では診断依頼を受けた場合,通常病理組織検査用には5-10個体程度のサンプリングをお願いしている。これは最低5個体くらいはないと判断が難しいのと,理想的にはサンプル数は多ければ多いほどよいが,あまり個体数が多すぎても処理しきれないからである。
(2) 極力,典型的な病魚を選んでサンプリングする。それが無理なら少なくともどのような魚をサンプルしたかを必ず記録する。
数だけでなく,群れの中のどんな魚(動物)を(どのように)サンプルしたかによって診断結果は異なる。たとえば,ある養魚場の一つの網イケスで一日数%の割合で死亡が認められるようになったとしよう。網イケス中には数千の魚がいるとすれば,これは大量死である。死亡魚は横転して衰弱して死んでいくのが特徴であったとする。ここで横転してひん死になったもの10尾を選んでサンプルしたところ,サンプル中2尾の脾臓中にウイルスによるものと推測される異型肥大細胞と炎症が観察され,この病変は重篤化すれば十分致死的になりうるとする。それでは果たしてこの病変が大量死と直接の因果関係がある可能性が高いと言えるだろうか? この場合は必ずしもこの病変が大量死と関係あるとはいえない。大量死のバックグラウンドに,ある特定の疾病が存在するとすれば,典型的な症状の魚ばかりサンプルしたのであるから,大量死と関係ある病変ならもっと高頻度で見つからねばならないと考えられる。一方,外観的に健康に見える個体も含めて,群の中からランダムに10尾をサンプルして調べたところ,やはりサンプル中2尾に同様の病変が見つかったとしよう。この場合はどうであろうか?今度はランダムにサンプルした中で2尾に病変が見つかったのだから,その割合は20%であり,この疾病が大量死を引き起こしていると考えても矛盾はない。
以上のように,同じ組織学的観察結果が出たとしてもサンプリングをどのように行ったかによって魚群全体の診断は異なってくる。さらに実際の診断には飼育状況など,手に入る全ての情報を考慮する必要がある。また組織病変から臨床症状が説明できることが望ましい。これらのことから明らかなように,大量死における病理組織学的な診断のためのサンプル(他の診断でも同様だと思うが)は,典型的な病魚を選ぶのが望ましい。より理想的には全く症状のない魚を対照群として(できれば病気が発生していない群から)同時にサンプルするのがよいが,通常はそこまではしないことが多い。これはつまり,病理組織の観察者がその動物の正常な組織像がどんなものか十分知っていると仮定しているということである。また,種苗生産過程においては対象動物が非常に小さく病気に罹患しているものを選択してサンプルするのが不可能な場合もある。いずれにせよ少なくともサンプルには必ず「どのような状態の動物をサンプルしたか」あるいは「どのようにサンプルしたか」を付記しておく必要がある。それによって診断が変わってくるからである。
1. ある養魚場でヒラメのまとまった斃死が続き,診断依頼があった。罹患魚は水槽中をふらふら遊泳し,やがて死んでいくという。累積死亡率はひと月で20%に達したということであった。中枢神経の異常も疑われたため,異常遊泳をしている個体を選んで5尾をサンプルし,脳を含めた各臓器を固定してもらい,組織学的検査をおこなった。すると1尾の脳に,おそらくKudoa yasunagaiと思われる粘液胞子虫のシストが多数認められた。ただ,脳にはシスト周辺も含めて炎症像や組織の変性は見られなかった。他の個体の脳では複数個所の切片を検査したものの,寄生体は全く認められなかった。さらに,5個体すべてにおいて他の内部臓器には異常が認められなかった。念のためK. yasunagaiに対するプローブを作成してin situ hybridizationも行ったが,シスト以外に当該粘液胞子虫のシグナルは検出されなかった。この結果から,粘液胞子虫は異常遊泳を伴う今回のへい死の原因とは言えないと判断され,原因不明とせざるをえなかった。なお,担当の水産試験場における脳の新鮮圧偏標本の観察でも,異常遊泳を示すヒラメ10尾を検査して粘液胞子虫のシストが見られたのは2尾だけだったということであった。
2. カキのへい死原因の検査依頼があった。同じ由来の種苗を異なる養殖場で飼育していたが,そのうちのある特定の養殖場でのみ高率で死亡がおこり,そこでは1月で10%程度が死亡した。担当水産試験場で,当該養殖場のカキ6個の新鮮標本を観察したところ,うち2個の鰓で繊毛虫が観察されたということであった。カキは外観からは病気の個体と健康な個体の区別がつかないため,ランダムに14個体をサンプルして組織を固定してもらい,病理組織学的観察を行った。その結果,3個体において外套膜と鰓の上皮が広範囲にわたって死亡・脱落しているのが観察され,外套膜では病変部分に無数の遊走細胞の浸潤とそれらの細胞死が見られた。また,この3個体には体外および病変部の組織内に多数の繊毛虫が観察された。この3個体において,他の内部臓器はほぼ正常であり,特筆すべき病理変化は見つからなかった。また,この3個体以外の個体では特に組織学的異常は見られず,繊毛虫も全く観察されなかった。これらのことから当該養殖場のカキの主たる死亡原因は繊毛虫による障害のためであると判断された。
(3) 病勢が収束に向かい始めると病原体の検出は難しい。したがって,未知の疾病が疑われる時は,極力早い段階でサンプルをとっておく。
病勢が収束に向かい始めると病原体を検出するのは非常に難しくなる。したがって,病気が拡大しつつあるときにサンプルするのが望ましい。増養殖研究所に不明病の依頼がある場合も,いろいろと診断を試みてもうまくいかず,病気が収まってきたころやっと診断依頼が来る,というケースが多い。このような場合,病原体を検出しようとしてもすでに手遅れになっていることが多い。したがって,疾病が起こり,未知の病気かもしれないと思われる時は,念のために,たとえ無駄になってもなるべく早い内に典型的病魚を選び,病理組織標本や,感染実験や病原体分離のための凍結標本(なるべく多く,なるべく急速凍結),あるいは遺伝子診断のための100%エタノール固定標本などをサンプルしておくのがよい。
(4) 病理組織標本は生きた動物からサンプルする。
水産動物は哺乳類と較べ,死後の自己消化が極めて急速に進行する。魚種や保存状態にもよるが,死後30分も経てば,消化管や膵臓などの自己消化がかなり進行している場合が多い。自己消化は特に病変部でより早く進行する。したがって,死んだ動物は病理組織サンプルには適さない。死んだ動物しか手に入らない場合は別にして,極力生きた個体からサンプルするようにする。サンプルする動物を生かしてキープしておき,そこから一尾ずつ麻酔して固定操作を行うのがよい。現場が研究室から離れている場合には,現場に固定液や解剖道具を持ち込み,その場で組織固定を行うのが望ましい。以下にいくつかの実例を挙げる。
1.(成功例) 全長35-40 cm程度のハマチの組織をサンプルする必要があった。病魚は網イケスで養殖中のものであり,しかも研究室から養殖場まではかなり離れており,数時間かかる。イケスから弱った魚をとりあげ,せまいタンクに入れておいても,一尾の組織サンプリングに20分近くかかるため(脳をサンプルする必要があった),死んでしまうことが予想された。そこで現場に出向き,現場の漁協事務所を借りた。イケスから病魚をタンクに入れて生かして事務所に持ち帰って,魚体の温度を下げるために全個体を海水氷に漬け,ただちに脱血して海水氷に戻した。そこから順に組織のサンプリングを行った。最終的な組織の形態保存はまずまず良好であった。
2.(成功例) さる河川で野生のアユが大量斃死を起こしており,その診断依頼が水産試験場から増養殖研にあった。現場は水試から離れており,河川で弱って流れてきたアユを採捕しても水試に持ち帰るまでに死んでしまうことが予想された。事前に水試担当者から連絡があったため,衰弱したアユが獲れたらすぐに氷水に入れて,それを研究室に持ち帰ってから組織サンプルを取ってもらうようにした。組織は消化管上皮が一部で崩壊しはじめていたが,他は十分観察可能であった。
3. (失敗例) マスの稚魚の診断依頼があった。担当者は現場の養殖場で衰弱した病魚(全長6-7cm)をサンプルし,生かしたまま,研究室に持ち帰ろうとしたが,2時間程度の移送の途中で死んでしまった。研究室に帰ってから腹部に切れ目を入れた状態で固定液に投入した。組織は消化管や膵細胞,肝臓などが自己消化を起こして崩壊し,かつ周りの組織も消化され始めており,腹壁の筋肉も一部消化されているような状態で,ほとんど観察不可能であった。サンプリングについて事前に相談していただければよかったのだが…
4. (失敗例) 変態直後のヒラメ稚魚の診断依頼があった。担当者は衰弱した稚魚と死亡直後と思われる稚魚を一緒にサンプルして,丸ごと固定液に投入した。変態直後のヒラメであれば普通は麻酔して丸ごと固定液に投入すれば十分な固定が可能である。しかし組織標本を作ってみると,10固体中7個体はサンプル時に死亡していたものと思われ,腹腔内臓器は自己消化で崩壊,液状化していたため観察できず,一部は体側筋も消化されていた。残りの3個体は内部臓器の形態がしっかり保存されており,固定時に生存していたと思われた。担当者は,病理組織標本というのは固定液にサンプルを放り込めばそれでよいという程度の認識しかなかったようだ。これも事前にサンプリングについて相談しておいていただければ…
(5) 症状にあわせたサンプリングを行う。
通常の不明病の病理組織検査でサンプルする組織は,ある程度魚が大きければ,鰓,心臓,腎臓,腹腔内臓器,および脳である。特に異常遊泳が見られる場合など,中枢神経の異常が推測される場合には当然脳(あるいは脊髄も)をサンプルする必要がある。また普通は体側筋や皮膚のサンプルは行わないが,そこに臨床症状があればそれらをサンプルする必要がある。すなわちサンプルする臓器は症状によって臨機応変に選ぶ必要がある。例えば以下のような事例があった。
1. ハタの診断依頼があった。粘液胞子虫性ヤセ病が疑われるとのことであったが,サンプリングの前に電話による問い合わせがあり,緑肝症状を呈し胆嚢が肥大している個体が多いという情報を得た。そこで,通常サンプルする臓器以外に,総胆管も固定してもらった(胆管がどこにあるか,解剖学の知識が必要)。病理組織検査の結果,粘液胞子虫性ヤセ病であることが判明したが,胆管上皮にも粘液胞子虫が寄生し,どの個体にも上皮の剥離と細菌を交えた激しい炎症が見られ,多くで総胆管が閉塞しており,そのため緑肝が生じていることが判明した。また総胆管の炎症部位から胆管を通じて侵入した細菌によって肝臓に膿瘍や肉芽種が形成されていることがわかった。この事例の場合,通常通りのサンプリングでは,粘液胞子虫性ヤセ病という診断は可能であったが,肝臓の病変の病理学的説明は困難であったと思われる。
このように,症状に関する詳しい情報とそれに合わせたサンプリングが重要であり,病理組織標本を固定する際には,病理組織検査の担当者と事前にどのようなサンプリングをすべきか相談するのが望ましい。もちろん本来は病理組織検査を行うものが自身でサンプルするのが理想である。
実際の組織固定方法
組織学的方法のうちで最も重要な部分である。単に組織を適当に切りだして固定液に入れておけばよいと安易に考えるのは大きな間違いである。固定に失敗すれば,その後の技術がいくら優れていようと,もう取り返しがつかない。固定が成功すれば,プレパラート作成は8割方成功したといってよい。固定する組織は大きい方が後の操作がやりやすい。しかし大きすぎると固定液が内部に浸透せず,十分な固定ができない。また,ミクロトームで切れる切片の大きさにも限界がある。このため,どんな大きな動物を用いても,固定できる組織片の大きさは自ずと上限がある。別の言い方をすればどんな大きな魚でも,1尾の組織を固定するのに必要な固定ビンの大きさはそれほど大きくなくてよい,ということである。もちろん,個体が大きい場合,臓器から多数の小片を切り取って固定,観察すれば,それだけ個体ごとの診断の精度・感度は高くなるが,通常水産動物の場合,それよりも個体数を増やす方が重要である。
組織学のための固定は魚類学などのホルマリン標本とは異なり,図1のようにたとえかなり小型の魚でも腹部に切れ目を入れて固定液に放り込んだだけでは極めて不十分な固定しかできない(図 2 および 3)。これは先に述べたように,魚あるいは水産無脊椎動物においては死後の自己消化が極めて速やかで,固定液が浸透するまでの間に内部臓器の自己消化が進んでしまうからである。一つの固定ビンには1個体から採取した組織を一緒に固定するのが普通である。また,固定液の量は目分量で組織の10倍以上になるようにする(図 4)。
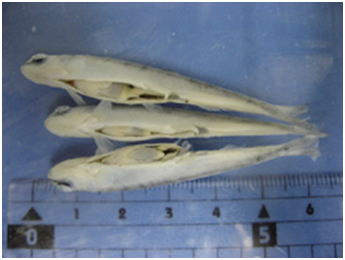
図 1
病理組織のために固定された小型のニジマス。定規のメモリは1cm。腹部に切れ目を入れてあるが,適切に固定するためにはこれだけでは到底不十分である。この大きさのマスなら,腹腔内臓器をまとめて取り出し,腹腔内臓器全体を体軸に垂直に3個程度に切り分けて固定する。もう少し小さければ鰓蓋から肛門にかけて2,3か所で,よく切れるメス等で完全に輪切りにして固定してもよい。
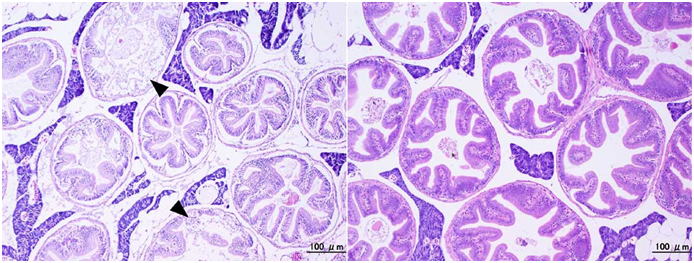
同時に固定した2個体のアユ(全長5cm程度)の幽門垂の輪切りの切片。HE染色。左側の個体は腹部に縦に切れ目を入れただけで全身をDavidson液で固定した(図 1のニジマスと同様)。右の個体は腹腔内臓器を丸ごと取り出し,いくつかの輪切りにしてからDavidson液で固定した。左の組織ではすでに上皮の一部が崩壊している(矢じり)。また,エオシンに対する染色性が弱く,タンパク質が自己消化によってかなり失われているものと思われる。切片は両方とも3μmで作成した。
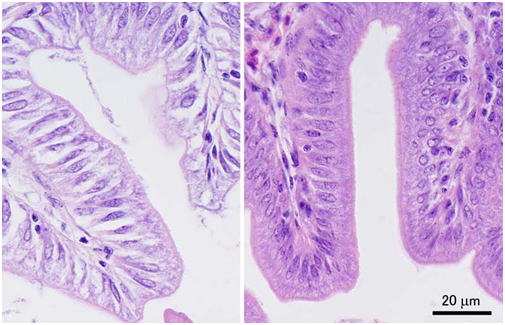
前図と同じ組織標本を高倍率で示す。図2の左図では上皮構造の一部がまだ保たれているように見えたが,このように高倍で見比べると細胞形態の保存状態,染色性ともに悪い。左側の組織ではまるで中身が抜けてしまったかのように上皮細胞が収縮して,細胞間に隙間ができている。両図とも同倍率。
組織と固定液の量のバランスはこのくらいがよい。この例では固定液と組織の実際の重量比は,ほぼ20:1になっている。固定液は固定ビンいっぱいに入れず,ビンの70-80%くらいまで入れる。このほうがビンを揺すった時によく撹拌される。
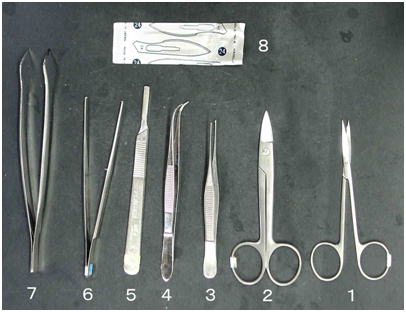
図 5
小型の魚の組織を採取,固定するための解剖道具の例。1,眼科用先曲がり剪刃;2,金冠バサミ;3,小型のピンセット;4,小型先曲がりピンセット;5,メスの柄(4番);6,カギ付きピンセット;7,先曲がりピンセット;8,メス替刃(No. 24,刃渡りの長いものがよい)。
そのほかに必要な物
麻酔液
2-フェノキシエタノール
ペーパータオル
固定ビンと固定液(なるべく氷冷しておく)
以下に組織学のための解剖とサンプリングの手順の一例を示すが,もちろん実際には状況に合わせて臨機応変に行う必要がある。現場で行う場合,理想的な方法をとることができないのが普通であるが,なるべく工夫して理想に近づけるようにする。
- (1) 解剖台として濡らして,適当に絞ったペーパータオルを準備する。組織を割断するときにすべらないので便利。
- (2) 組織を採取する個体群から1尾をとって麻酔する。麻酔によって光顕の病理組織像はほとんど変化しない。原則として,死亡した動物は用いない。やむを得ず死んでしまった場合,あるいは事前に死ぬことが予測される場合は,氷水や海水氷を用意し,その中に解剖まで入れておく。その場合でも極力速やかにサンプルするようにする。
- (3) 脱血する(図 6)。仔魚などでは省略。大型の個体は尾柄部から注射筒で脱血する。普通は体重の1.5%くらい血液が抜ける。エラの付け根や尾柄を鋭利な刃物で切断して放血させてもよい。脱血せずに血液が鬱滞したままだと観察に支障をきたすことがある。脱血の時,必要ならば血液塗沫標本を作製する。
- (4) 組織を切り出す。
固定する組織片はおおむね厚さ(高さ)5mm程度の小片とする(あまり厳密にやる必要はないが)。底面積はもっと広くてよい。あまり小さいと観察できる範囲が狭くなり,診断の感度や精度が低下する。臓器は丸ごとより割断したほうが固定液が浸透しやすい。原則として,臓器は以下の順に採取する。1. 鰓および皮膚(皮膚に肉眼的に病変が見られる場合) 2. 腹腔内臓器 3. 腎臓 4. 心臓 5. 脳。 皮膚や鰓を先にするのはこれらが傷つきやすいためと乾燥しやすいためである。特に皮膚は取り扱いにより傷つけやすいので,採取する場合は,その部分に極力触れないように気をつけてハンドリングし,サンプルする。このとき,皮下の筋肉層もつけたまま,普通は体軸に垂直に(筋肉が輪切りになるように)組織片を切り出す(図 7)。筋肉も同時に観察するときは極力ハサミを使用せず,メスあるいは剃刀の刃のみで切り出す。ハサミで切ると切れ目からかなり離れた部分まで組織が挫滅してしまうからである。種苗生産過程の仔魚(たとえばヒラメなら変態直後(全長15mm以下)くらいまでの大きさ)は麻酔した魚体をまるごと固定液に投入してよい。それより大きくなれば鰓蓋の直後で頭部と体躯幹部を切り離して固定する。もう少し大きくなれば腹腔内臓器はバラバラにしないで丸ごと取り出す。そのときは腹腔内蔵器のかたまりをメスで体軸と垂直な面で割断して消化管内部に直接固定液が入るようにする。サケ・マス類の浮上前の卵黄嚢を持つ仔魚であれば,丸ごと固定液に投入する。しかし,浮上後摂餌を始めた稚魚は鰓蓋の直後,および腹腔のある部分1-2カ所を輪切りにして固定液に投入する。魚の大きさが4 - 5 cm以上あると腹腔を切り開いただけでは臓器の内部まで固定されないので,腹腔内臓器をまるごと取り出し(図 8),取り出した腹腔内臓器を崩さずに輪切りにして固定する(図 9)。もっと大きければ,臓器毎に切り出して固定する。さらに大型の魚の場合は臓器ごとにその一部を切り出して固定する。軟組織を割断する場合は,組織の方向を決めるために,濡れたペーパータオルを適当に折り曲げて組織を適切な向きに置いてから割断し,5 mm厚程度のブロックにして切り出す。切り出した組織片は濡れたペーパータオルに端を接触させ,血液や体液を吸い取らせてから固定液に投入する。魚が摂餌していた場合,腸管内は活性のある消化酵素で満ちているため上皮は消化液で崩壊しやすい。にもかかわらず腸管内部には固定液が入りにくいため,上記のように消化管を含む臓器を輪切りにし,腸管内部に直接固定液が入り込むようにして固定するのである。魚体が大きければ消化管は1cmくらいの土管状にして固定する。この時,両端がめくれ上がってもかまわない。要は消化管上皮に直接固定液が触れるようにすればよいのである。ただし,多数の幽門垂が房状にまとまっている魚の場合は,幽門垂に垂直に割断して断面を出し,全体を5mm厚程度の輪切りにして,まとまった幽門水を崩さないようにしてそのまま固定する。それによって幽門垂の間の膵臓や腸間膜の病変が観察できる。魚体が大きく臓器を一部ずつ切り出す場合,腸管に付随する腸間膜などを切り離さないようにする。腸間膜を別に採取してもよい。この部分には膵臓があり,またしばしば腸間膜状に炎症が見られることも多いからである。腎臓はふつう実質が多く含まれる体腎部分を採取する。小型魚の場合,脊椎や筋肉を含めて体腎をいったん魚体から切り出し,周辺の脊椎や筋肉をなるべく取り去ってから固定液に投入する(図10)。しかし周辺の組織を完全に取り去る必要はない。より小さい魚の場合,腎臓は輪切りにした胴体ごと固定してよい。心臓は鰓蓋の下方奥に存在する。心室と動脈球を一緒に切り出すが,心房も一緒に取れてくるのが普通である。可能なら動脈球も含めて正中面に平行に2つに割断して大きい方を固定する。脳の採取は時間がかかるためふつうは最後にする。特に異常遊泳等の神経系の異常が疑われる症状がなければ脳のサンプリングは省略することもある。小型魚の場合,まず頭部を鰓蓋の直後で切り離し,次に下あごを切り落とす。さらに上あごについた余分な組織,眼球より先の吻端,眼球を含めた脳函の左右の組織を切り離し,脳函のみにする。さらに頭蓋の一部をはがして脳に直接固定液が接触するような状態にして固定液に投入する(図 11)。より魚体が小さい場合には,心臓も含めた頭部は断頭しただけでそのまま固定してよいし,ただし,しばしば口腔に空気が溜まって固定液の浸透を邪魔するので気をつける。また,大型魚において脳を完全に取り出して固定したい場合は,頭蓋上部と左右をなるべく取り去り,脳を完全に露出させてから延髄より後ろをピンセットでつまみ上げ,眼科用剪刃で後ろから順番に神経を切り離しながら,脳全体を取り出し(この時下垂体はほとんどの場合脳函の底に残る),場合によってはさらに小さくトリミングしてから固定する。
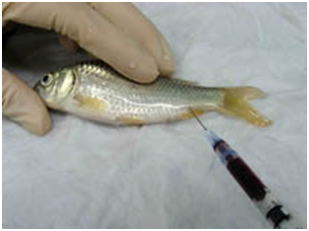
図 6 麻酔した魚の尾柄部からできるだけ多くの血を抜き取る。(コイ)
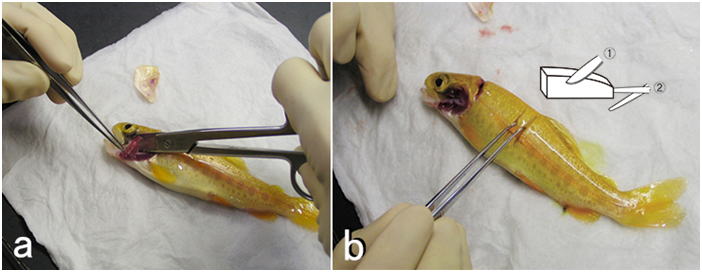
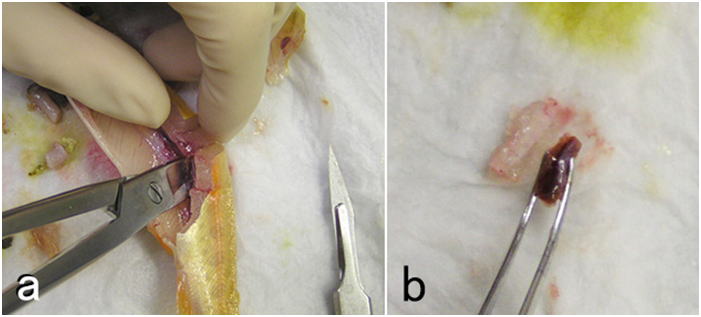
ニジマス。 a: 鰓ぶたを開けて鰓弓を切り出し,固定する。b: 皮膚をとる場合はメスで5mm幅のスリットを切り(1),ハサミでその間の皮膚を下の筋肉ごとかまぼこ型に切り出す(2)。
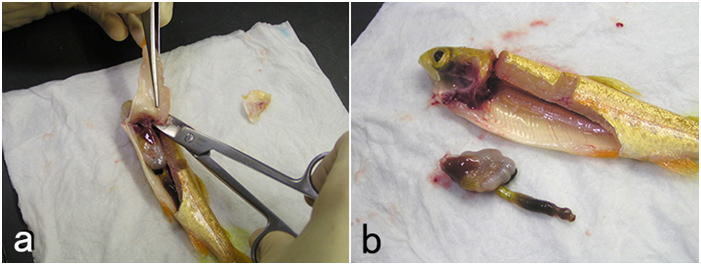
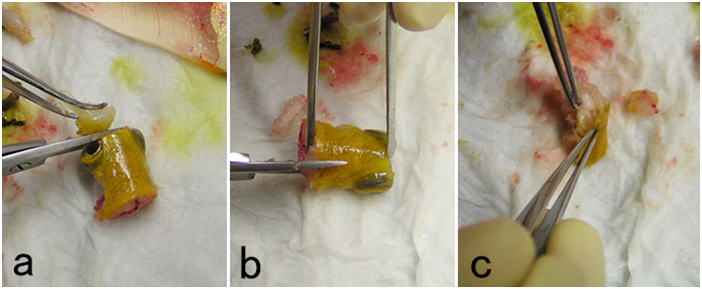
ニジマス。a: 肛門のわずかに前方から切れ目を入れ,腎臓ぎりぎりの部分にハサミを入れてなるべく大きく腹腔を露出させる。解剖前に脱血しているため腹腔内が血液で汚れていないことに注意。 b: 肛門と食堂で消化管を切断し,腹腔と癒着している部分を切り離して,腹腔内臓器を崩さずに丸ごと取り出す。
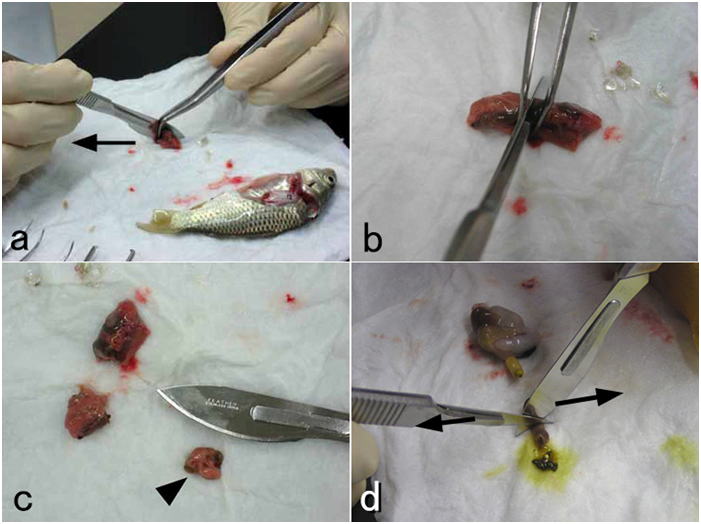
腹腔内臓器は崩さずに丸ごとの塊で取り出し,元の体軸方向に垂直に5mm程度の厚さの小片を切りだして固定する。全体を数個の小片に分けて固定してもよい。a:メスの刃をピンセットの先端の狭い隙間を水平方向に滑らせるように引いて割断する。このときメスの動きに臓器が引っ張られないようにピンセットの先端で臓器を抑え,その間にメスの刃を通して引くようにする。臓器をひとつひとつ切り離さないようにする。矢印はメスを動かす方向を示す。組織を挫滅させずに刺身を作る要領で切る。b: aを上から見たところ。c: 切り出した組織小片(矢じり)。d: あるいは二つのメスないし剃刀の刃を接触させて交差させ,矢印で示すように左右に引いて割断してもよい。a-c: コイ。d: ニジマス。
小型のニジマスの腎臓の固定。a: 腹腔後部の体腎を採取する。腎臓に傷をつけないように周囲の筋肉や脊椎ごと切り出す。 b: すばやく周囲の筋肉や脊椎などを取り去って固定する。余分な筋肉や骨は固定が完了してから除くことができるので,この段階で無理してきれいに腎臓だけにする必要はない。固定が完了してから余分な組織を取り除けばよい。
小型のニジマス脳の固定。a: 鰓蓋の後ろで断頭し,下あごを除いた頭部から,眼球より先端部分を切り落とす。 b: 側頭部を眼球とともに切り落とす。 c: 頭蓋上部にハサミの刃を押し付け,脳に傷をつけないようにして脳函に切れ目を入れ,ピンセットで頭頂部をはがし,脳を一部露出させて固定液に投入する。
なお,見た目に異常があればその部分をサンプルする。その時,異常な部分と正常な部分の境界を入れてサンプルするようにする。無脊椎動物も基本的には同様にサンプルするが,魚類よりさらに自己消化が早いことが多いので注意が必要である。エビは死後中腸腺があっという間に自己消化を起こしてしまう。そこで理想的には中腸腺の内腔(横から),中腸腺より前の部分,中腸腺より後ろの部分,前方および後方の腹節にそれぞれ注射器でDavidson液を注入する。さらに各腹節の横から頭胸甲の上部正中線の少し横を体軸に平行にハサミで甲殻に切れ目をいれる。エビが12g以上の場合は,さらに頭胸甲と腹節の間,および中央の腹節間に切れ目をいれ,全体を固定液に投入する。(この方法は「Bell and Lightner (1988) “A Handbook of Normal Penaeid Shrimp Histology” The World Aquaculture Society, Baton Rouge, Louisiana」による。)この方法が面倒であれば,少々乱暴でも頭胸甲を切り離して,カミソリ等で頭胸甲に体軸と平行に斜め方向から(中腸腺の真上にある生殖腺や心臓を傷付けないため),中腸腺内腔まで達する切れ目をいれて固定する。とにかく重要なのは中腸腺の内腔に直接固定液が達するようにすることである。アワビでは,殻長2cm程度以下の個体はそのまま殻ごと固定してよい。それより大きくなれば,殻をはずし,軟体部を割断して固定する。そのとき消化盲嚢は必ず割断されているようにする。大きさによって割断面の数を増やすか,あるいはもっと大きくなれば器官ごと,あるいは各器官の一部を切り出して固定する。二枚貝でも同様にして固定するが,小さい個体でも少なくとも片方の殻を外し,軟体部を露出させて固定する必要がある。アワビ以外の通常の巻貝では,軟体部をつぶさない様に殻を金づち等で軽くたたいて割り,ピンセット等で殻をはずし,小さければ軟体部をそのまま,大きければ割断するか,臓器ごと,あるいは各臓器の一部を切り出して固定する。
組織片は切り出したら即固定液に投入し,そのたびごとに,ビンのフタをして攪拌する。通常,一つのビンには1個体分の組織を入れるようにする。全部の組織を入れ終わったら,ただちにビンを横にして振とう器にかける。振とう器が無い場合は頻繁にビンを攪拌する。特に組織投入直後は頻繁に攪拌するようにする。固定ビンを静置したままにしておくと,組織の周辺の固定液しか組織の固定に利用されず,しかも組織周辺の固定液は組織液によって薄まってしまう。したがって,組織投入直後ほど頻繁にビンを上下にして振とうし,組織周辺の固定液を常に新鮮なものにしておく必要がある。激しく振とうする必要はなく,組織周辺の液が交換されれば十分である。固定後移動する場合は,ビンを横にして運び,移動中なるべく液が攪拌されるようにする。いかにすばやく細胞内の消化酵素を不活化して自己消化を阻止するかが重要である。振とう器が無い場合は,組織を固定液に投入後最低30分程度は数分おきに上記のように固定ビンを振とうする。その後は静置してよい。一晩固定したら70%エタノールで振とうしつつ1時間程度洗い,さらに新しい70%エタノールに変えて保存する。理想的には固定液の温度は固定が終わるまでは低いままのほうがよいが,特別気温が高くなければ実際には組織を固定液に投入した後は室温で操作してもほとんど問題はない。
固定液の種類:ホルマリンのみの固定液は不適
通常の病理組織学的観察のための固定液としては,固定剤がホルマリンのみの固定液(10-20%ホルマリン,中性緩衝ホルマリン液等)は十分な固定ができないので避ける。もし,組織学が最初に水産動物を基準にして確立されてきたのだったら,10%ホルマリンが標準的な固定液とされることは決してなかったであろう。しかし現在の組織学はほ乳類を基準に作られている。ほ乳類の組織は水産動物に比較して死後の自己消化が遅いため,(融解壊死よりも凝固壊死が優先するためか)10%ホルマリンによる固定でも光学顕微鏡レベルでは十分な結果が得られる。組織学的方法に関する教科書はほとんどが医学分野のもので,したがってヒトを含む哺乳類の組織の観察を前提に作られており,10%ホルマリンが標準的な固定液として推奨されている。そのためか魚介類にはホルマリンのみの固定液は向かないという事実は組織学者ほど信じてもらえないようである。しかし魚介類はほ乳類に較べ自己消化が非常に早く,後に示すように実際に多くの場合ホルマリンのみでは固定しきれない。ホルマリンは組織に浸透してもすぐにタンパク質を固定しないため自己消化が進行してしまうと考えられる。10%ホルマリン液が軟組織中のタンパク質の95%を固定するには3時間程度かかるといわれる(水平,1990)。Davidsonの固定液と10%中性緩衝ホルマリン液にニジマスの肝臓を室温で浸漬し,35分後に水溶性タンパク質を抽出して量を測定してみたところ,Davidson液固定標本では,抽出されてくる水溶性タンパク質はほとんどないのに対し,ホルマリン固定では生鮮組織の1/3程度のタンパク質が溶出してきた(図 12)。
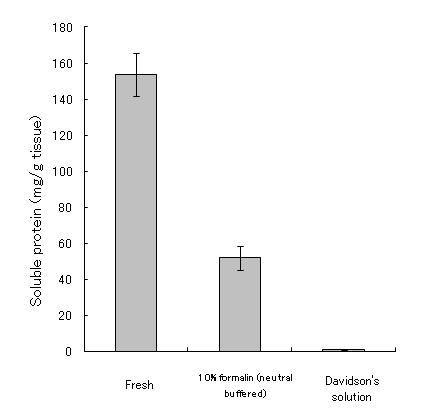 図 12
図 12
2つの異なる固定液で35分間組織を固定した後に残存する水溶性タンパク量の比較。体重250gのニジマスの肝臓から12個の組織片を切り出し,重量を測定(1片70-80mg程度であった)。うち8個をいっせいに固定液(4個はLilieの中性緩衝ホルマリン液,4個はDavidson液,組織片1片あたりそれぞれ15 ml,投入時の水温16.5℃)に投入し,振とう器にかけた。残り4個の肝臓片は固定せずに重量の4倍の10 mM PBS(1gの組織に対し4ml)中に投入し,ポリトロンでホモジナイズし,遠心して上澄みを採取。固定液中の組織片は35分後に,いっせいに氷冷したPBS中に投入し,振とう。ひとつずつ重量の4倍のPBS中に投入し,ポリトロンでホモジナイズし,遠心して上澄みを採取した。Bio-Radのタンパク質測定キット(ブラッドフォード法)で上澄み中のタンパク質濃度を測定した。使用した2つの固定液はタンパク測定に影響しないことが事前の実験で確かめられている。ブアン液とヘリー液は測定に影響を与えるため,この実験には含めていない。バーに付属する縦線は4重検定内の標準誤差を示す(つまりバーで示されるデータは一つである)。
これはまだ固定されていない水溶性タンパク質や自己消化により溶出してきたタンパク質が抽出されてきたと考えられる。Davidson液やBouin液では,液中のエタノールや酢酸,ピクリン酸などが速やかに自己消化にかかわる酵素を含むタンパク質を変性・凝固させ,そのあとからホルマリンがゆっくり化学変化をタンパク質に起こさせることにより固定が進行すると考えられる。10%中性緩衝ホルマリン,Davidson液,Bouin液,Helly液という4種の異なる固定液の性能を体系的に比較すると,組織学のための形態の保存に関して全体的にはDavidsonの固定液が優れていることが示される(図 13-17)。Bouin液も優れた固定液ではあるが,無脊椎動物では不十分なことがある。また固定した組織からピクリン酸を十分洗い流さないと徐々に染色性が落ちるといわれる。さらに,Bouin固定による組織切片はギムザ染色に対する染色性が極めて弱い(図 18)。水産動物の病理組織学においては細菌やカビ,あるいはさまざまな寄生体を観察する上でギムザ染色(われわれはMay Grünwald-Giemsa染色をルーチンで用いている)が必須であるため,このことは致命的である。Helly液は成魚の組織(特に神経や内分泌細胞など)を固定する時には非常に優れた結果が得られることもあるが,仔魚には不十分である(図 17)。また,脱パラ後水銀の沈着を除去する(方法は後述)必要があることや,さらには水銀やクロムを含む廃液の処理が問題となるため,使いにくい。このように通常の組織学においてはDavidson液が全体的に優れているが,この固定液にも欠点がある。その最たるものはホルマリン色素(ヘマチン)の沈着であり(図 19),後述のように脱パラ後ホルマリン色素の除去処理をする必要がある。ただしこの操作によりギムザ染色の染色性が悪化することはない。また,Davidson液で固定したサンプルでは結合組織が膨化し水腫状の組織像を呈しやすく(Bouin液も同様だがDavidson液より少しましか),かつ上皮が基底膜から剥離するアーティファクトが起こりやすい。これは特に鰓で頻繁に見られる(図 20)。さらに,Davidson液とBouin液は赤血球を顕著に溶血させる(図 21)。また,Davidson液は強力な固定液であるが,おそらくそのために抗原性の保存は悪く,抗原によっては免疫組織化学には適さないことがある。トリプシノーゲンは10%ホルマリン固定のみで抗原性が保存された(図 22)。これはやはりホルマリンのみではタンパク質の変性や修飾が弱いため,抗原性が保存されたのであろうと思われる。一方コレシストキニン(CCK)ではBouin固定のみで反応が見られた(図 23)。CCKはペプチドであり,おそらくホルマリンのみでは固定が不十分で,溶出してしまったか,あるいは自己消化を受けてしまったため反応が見られなかったのだと考えられる。一方Davidson液やHelly液ではやはり固定が強すぎ,わずかしかないCCKのエピトープが失われてしまったのであろう。しかし,我々はDavidson液で固定した組織においても病原微生物まるごとを抗原として作成した抗体による免疫組織化学では良好な結果を得ている。パラフィン切片のIn situ hybridization (ISH) に関してはどの固定液を用いたらよいのか決定的な結果は得ていない。魚介類の場合,やはり細胞内の核酸分解酵素を速やかに不活化するのが重要であると思われる。上記の4種類の固定液を用いて固定したヒラメの胃についてペプシノーゲン遺伝子のmRNAに対するISHを行ったところ,DavidsonおよびHelly液では非常に良い結果を得た。10%ホルマリン固定でも良好な結果を得たが,Bouin液では極めて弱いシグナルしか得られなかった。しかし他の研究室でBouin固定されたヒラメの胃のパラフィンブロックを借りてきて同様にISHを行ったところ非常に良い結果が得られた。なぜ同じBouin液による固定でこのように差が出たのかは不明である。もしかすると固定液を作製するのに用いた個々の試薬に問題があったのかもしれない。いずれにせよ特殊な染色操作をする場合には,その都度固定法を自身で検討する必要がある。
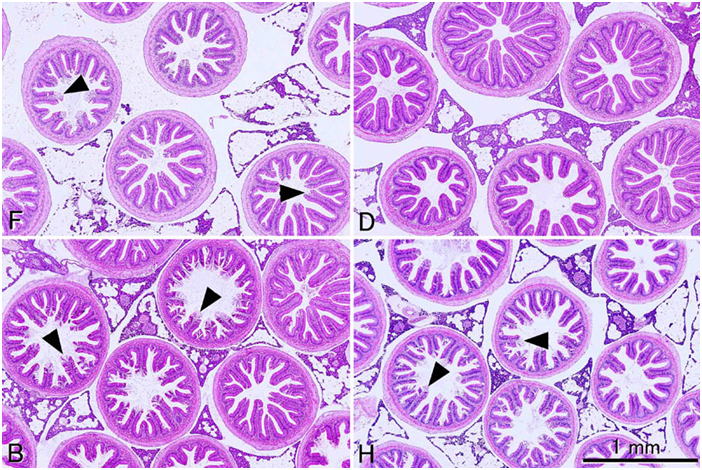
4つの異なる固定液で固定された幽門垂組織。F, 10%中性緩衝ホルマリン液;D, Davidson液;B, Bouin液;H, Helly液。すべて同倍率。組織は同一のニジマス個体から採取した。Davidson液以外の固定液で固定された組織では,しばしば上皮のひだの先端が自己消化のため崩壊している。切片はすべて3μm。HE染色。
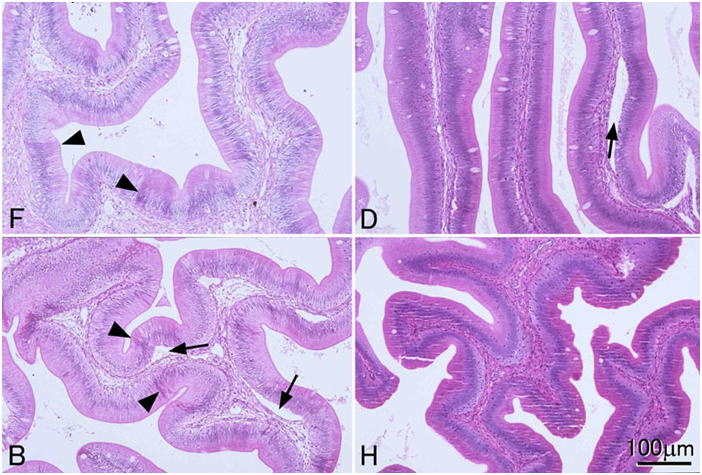
4つの異なる固定液で固定された腸管の粘膜ひだ組織。F, 10%中性緩衝ホルマリン液;D, Davidson液;B, Bouin液;H, Helly液。すべて同倍率。組織はすべて同一のヒラメ個体Paralichthys olivaceusから採取した。ホルマリン液およびブアン液で固定された組織では,全体に染色性が弱いが,一部で濃く染まる上皮細胞もある(矢じり)。これはおそらく固定が不均一であることを示すと思われる。矢印で示すスペースはアーティファクトにより上皮が剥離してできたもの。ヘリー液で固定した組織は切片にチャター(図Hの組織に見える横方向の多数のひび割れ。ミクロトームナイフと平行にできる。)を生ずることが多い。Daivdson液を用いた場合に最良の結果が得られている。 切片はすべて3μm。HE染色。
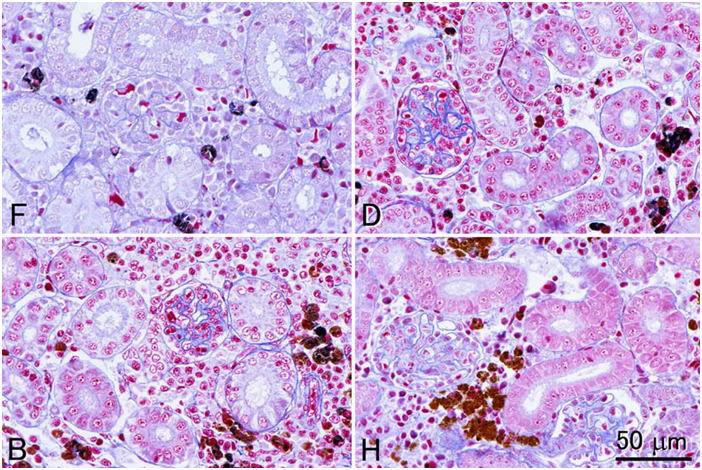
4つの異なる固定液で固定された腎組織の切片にアザン染色を施して比較した。F, 10%中性緩衝ホルマリン液;D, Davidson液;B, Bouin液;H, Helly液。すべて同倍率。組織はすべて同一のニジマス個体から採取した。単純なホルマリン固定のみではアザン染色でよい結果が得られないことは比較的よく知られており,それはこの図からも明らかである。図では一見Davidson液で固定した組織で最も良い結果が得られているようであるが,高倍で精査すると,実はHelly液で固定した組織のほうが,微細構造の保存も,部位ごとの染め分けもより優れている。この図の切片は全て2μm で作成している。
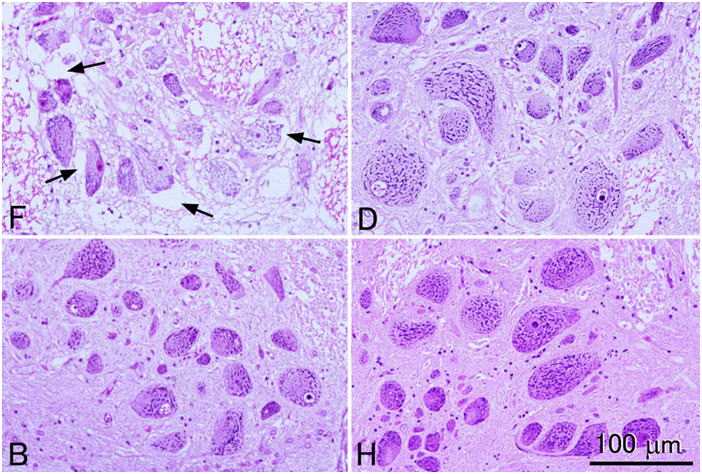
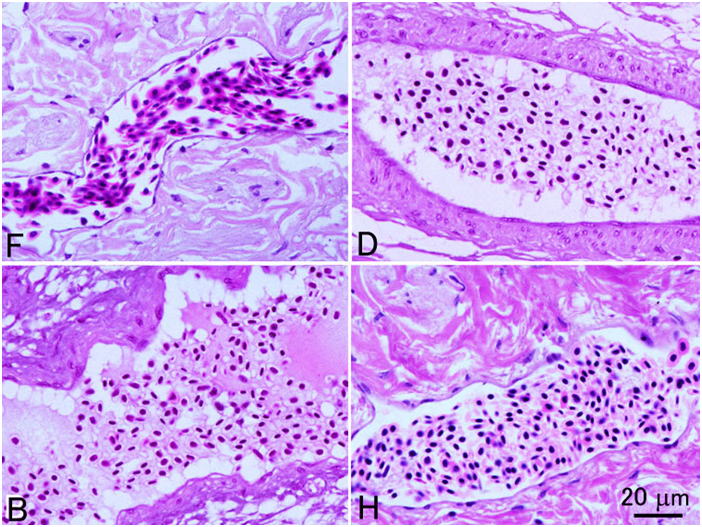
4つの異なる固定液で固定されたヒラメ脳(延髄)組織。F, 10%中性緩衝ホルマリン液;D, Davidson液;B, Bouin液;H, Helly液。すべて同倍率。10%ホルマリン液で固定した組織は他の固定液に比べて顕著に形態の保存が悪い。すなわち組織はスカスカで網目状に見え,おそらくニューロンの細胞体が収縮しているためにその周辺にアーティファクトによる空隙が生じている(矢印)。この図ではHelly液の結果が最も良いが,ヘリー液で固定した脳にはいわゆる「ダークセル」と言われる,おそらく固定時のアーティファクトにより非常に濃縮したニューロンないしグリア細胞が多くみられる(本図中には見られない)。Bouin液はDavidson液より優れた結果を示している。切片はすべて3μm。HE染色。
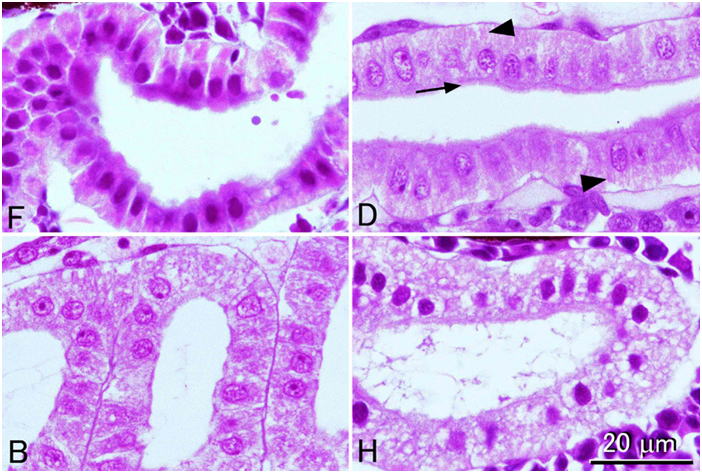
4つの異なる固定液で固定されたヒラメ仔魚の腎管。F, 10%中性緩衝ホルマリン液;D, Davidson液;B, Bouin液;H, Helly液。すべて同倍率。Davidson液固定によって最も良い結果が得られている。腎管上皮細胞内の赤い筋(矢じり)はおそらくミトコンドリアと思われる。また自由面に刷子縁(矢印)も確認できる。これらの構造がはっきり観察できるのはDavidson液で固定した仔魚のみである。10%ホルマリン固定では上皮細胞は濃縮しており,細胞内の構造ははっきり見えない。ヘリー液は成魚の組織ではすばらしい結果が得られることがあるが,仔魚を固定するのには明らかに不向きである。この例では上皮細胞の細胞質は網目状に抜けて見え,核は濃縮している。また, 10%ホルマリンとヘリー液による固定では間質の細胞も濃縮している。切片はすべて3μm。HE染色。
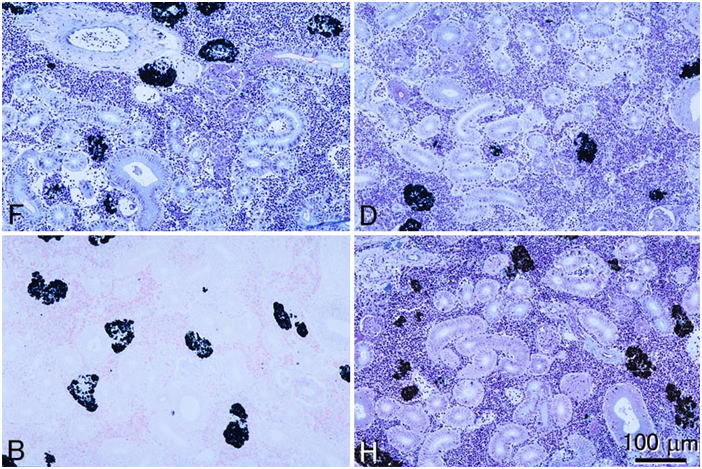
メイグリュンワルド-ギムザ染色を施したヒラメ腎臓切片。これらは同一の個体から採取された腎臓からさらに4つの小片を切り出し,それぞれを異なる固定液で固定したものである。F, 10%中性緩衝ホルマリン液;D, Davidson液;B, Bouin液;H, Helly液。すべて同倍率。一見して明らかなように,Bouin液は本染色には不適である。本染色は分別操作を伴うが,その時にBouin液で固定した切片ではあっというまにほとんど色素が抜けてしまう。切片は全て3μm。
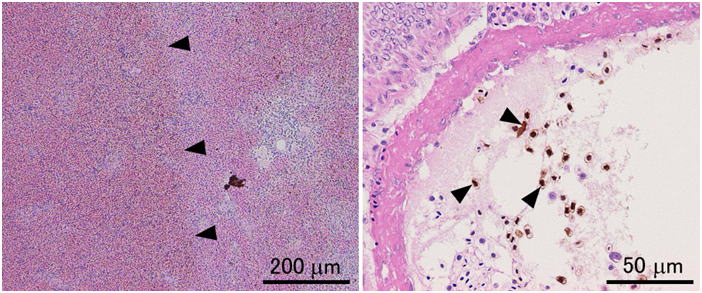
Davidson液で固定した場合は,脱パラ後ヘマチン(ホルマリン色素)の除去を行う必要がある。それをしないとこの図で示すように観察の時にやっかいなことになる。左の写真はヒラメの脾臓であるが,矢じりから左側がヘマチンの沈着のためにやや暗く茶色に変色して見えている。矢じりより右側は組織片の外側に近い部分で,包埋の過程でエタノールによってヘマチンが取り除かれている。右側はヒラメの血管内,特に赤血球に沈着したヘマチンを矢じりで示す。切片はすべて3μm。HE染色。
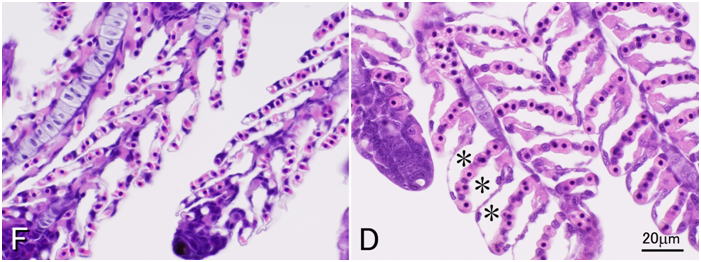
10%ホルマリン(F)またはDavidson液(D)で固定されたカンパチ仔魚の鰓組織を同倍率で示す。Davidson液で固定された組織では2次鰓弁の上皮が毛細血管から剥離してアーティファクトによる空隙(一部を米印で示す)ができている。固定に用いた10%ホルマリン液は緩衝液は用いずに1/3海水でホルマリン原液を希釈して作成した。切片は両方とも3μm。HE染色。
ヒラメの血管内の赤血球。組織は同一の個体から採取し,異なる固定液で固定したものである。F, 10%中性緩衝ホルマリン液;D, Davidson液;B, Bouin液;H, Helly液。すべて同倍率。どのような固定液でも溶血は起こるが,この図に見るようにDavidson液とBouin液では特に溶血が顕著である。この2つの固定液で固定された赤血球の細胞質はエオシンであまり染まらず,そのかわり血管内にエオシンで弱く染まるコロイド状の物質が見える。おそらく溶出したヘモグロビンではないかと思われる。10%ホルマリンで固定したサンプルでは赤血球は特にエオシンに強く染まっている。切片はすべて3μm。HE染色。
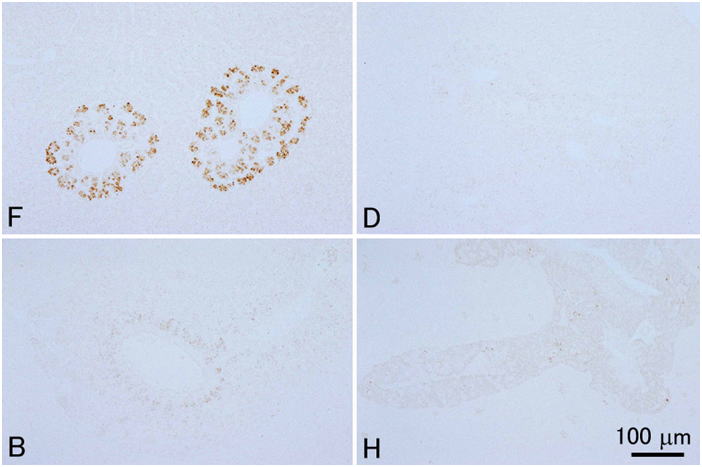
ヒラメ肝臓内膵組織のトリプシノーゲンの免疫組織化学。ウサギポリクローナル抗体を1次抗体として用いた。組織は同一の個体から採取されたものからさらに4つの小片を切り出し,それぞれを異なる固定液で固定したものである。F, 10%中性緩衝ホルマリン液;D, Davidson液;B, Bouin液;H, Helly液。すべて同倍率。10%ホルマリン以外の固定液では抗原性が失われている。切片はすべて3μm。対比染色なし。
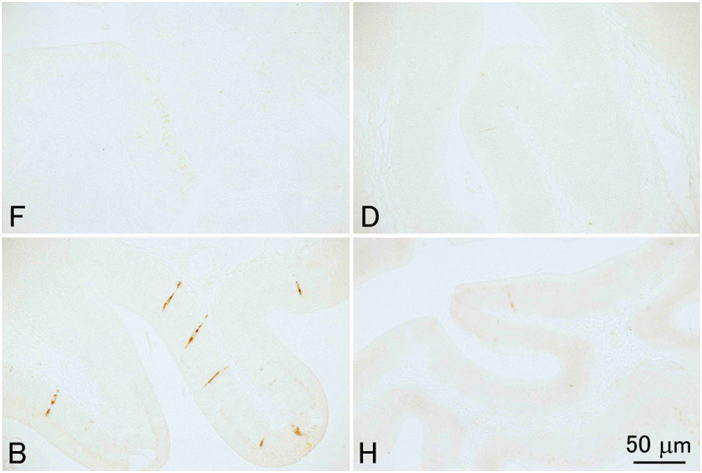
ヒラメ腸管上皮のコレシストキニンの免疫組織化学。ウサギポリクローナル抗体を1次抗体として用いた。組織は同一の個体から採取されたものからさらに4つの小片を切り出し,それぞれを異なる固定液で固定したものである。F, 10%中性緩衝ホルマリン液;D, Davidson液;B, Bouin液;H, Helly液。すべて同倍率。 Bouin液以外の固定液では抗原性が失われている。切片はすべて3μm。対比染色なし。
切片の厚さ
一般的に魚介類の組織切片はやむをえない場合を除いて3μmで作成するのが良い。なぜなら魚介類の細胞は哺乳類より一回り小さいため,それより厚い切片では細胞同士が重なり合って細胞内部が観察しづらくなってしまうためである。ホルマリンのみで固定した組織,あるいは固定が不十分な組織の場合は3μmでは組織がスカスカに見えるため(図 3),厚い切片のほうが一見みばえが良くなることがある。しかし理想的には組織はしっかり固定して薄切りし,濃く染めるのがよい。なお,低倍の写真を撮ることが予想される場合には,最初から厚い切片を一緒に作成しておくと,低倍でもコントラストのよい写真を撮ることができる。なお,サケ・マスやコイなどではかなり細胞が大きいため4μmの厚さで切片を作製しても十分である。これらの魚種は地質学的に比較的最近ゲノムの倍化を経験しているため核と細胞が大きいのだと思われる。
4種類の異なる固定液による固定結果の検討方法
実験に供試したのはヒラメ(Paralichthys olivaceus)未成魚4尾(体重214-254g),眼の移動開始直後のヒラメ仔魚20尾(体重10-20mg),およびニジマス(Oncorhynchus mykiss)3尾(体重123-129g)である。ヒラメは種苗生産業者から購入し,仔魚はアルテミアのノープリウス幼生を,未成魚は市販のペレットを給餌して実験まで20 ℃で飼育した。ニジマスは長野県水産試験場から供与を受け,市販のペレットを給餌して15-16 ℃で実験まで飼育した。
リリーの10%中性緩衝ホルマリン(pH6.9)はKiernan (2003)にしたがって調整した。Davidsonの固定液は95%エタノール,市販のホルマリン原液(37%ホルムアルデヒドおよび8%メタノールを含む),氷酢酸,および蒸留水を体積比で33:22:11.5:33.5の割合で混合した(Bell and Lightner, 1988)。(Davidson液の混合割合は3:2:1:3でも可。)Bouin液は飽和ピクリン酸溶液,市販のホルマリン原液,および氷酢酸を体積比で75:25:5の割合で混合した。Helly液は5gの塩化第二水銀(HgCl2),2.5gの重クロム酸カリウム(K2Cr2O7),および1gの硫酸ナトリウム10水和物(Na2SO4.10H2O)を含む100mlのストック水溶液に5mlの市販ホルマリン原液を加えて作成した。10%中性緩衝ホルマリン液は使用の24時間以上前に作成し,他の固定液は使用直前に作成した。
固定操作は室温(20-25 ℃)で行った。ヒラメ未成魚4尾は1尾ずつ2-フェノキシエタノールで麻酔後,尾柄部から注射器で脱血し,腸管,腎臓,および脳を切り出した。腸管と腎臓は同一個体の組織からさらに厚さ3-4 mmの4つのほぼ同じサイズの小片を切り出し,4つの異なる固定液で固定した。脳は正中面で2つに割断し,2つの異なる固定液で固定した。すなわち腎臓と腸管は1種類の固定液で4個体分の組織を固定したが,脳は1種類の固定液で2個体分の組織を固定した。固定ビンにはそれぞれ40mlずつ固定液を入れ,一本のサンプルビンで固定した組織の質重量の合計は0.62 ± 0.03 g (mean ± SEM)であった。 ヒラメ仔魚は20尾を一度に2-フェノキシエタノールで麻酔し,それぞれ45mlの4つの異なる固定液を入れた4本の固定ビンにそれぞれ5尾ずつを丸ごと投入して固定した。
Davidson液で固定した組織は,切片を脱パラフィンし無水エタノールから100%エタノールに移した後,ピクリン酸を飽和させた95%エタノールに5分間浸漬してヘマチンを除去した。その後切片を軽く水洗してから50%エタノールに1分間浸漬してなじませた後,流水中でピクリン酸の黄色が完全に消えるまで洗浄し,各種染色を施した。
Helly液で固定した組織は,切片を脱パラフィンし70%エタノールまで移してから,ルゴール液と70%エタノールを体積比で3:7の割合で混合した液に10分間浸漬して水銀を除去した。その後切片を軽く水洗してから0.25%チオ硫酸ナトリウム水溶液で30秒洗ってヨウ素の色を除去した後,流水で水洗し,各種染色を施した。
それぞれの組織から2組の3μmの切片を作製し,片方をマイヤーのヘマトキシリンとエオシン(eosinYとerythrosine)(HE)で,もう片方はメイグリュンワルド-ギムザで染色した。
ヒラメの肝臓中膵組織および腸上皮細胞のトリプシノーゲンおよびコレシストキニン(CCK)のそれぞれに対し,抗ウナギトリプシノーゲンウサギポリクローナル抗体(Kurokawa and Suzuki 1995)および抗ヒラメCCKウサギポリクローナル抗体(Kurokawa et al., 2000)を用いて免疫組織化学染色を行った。切片はまず1%BSA-10mMリン酸緩衝液(pH7.5)で1/20希釈した正常ヤギ血清で20分ブロッキングした後,1%BSA-10mMPBSで希釈した1次抗体(抗トリプシノーゲン,1/500希釈;抗CCK,1/100希釈)を40分反応させた。その後特異的に結合した抗体を市販のキット(VECSTAIN Elite ABC kit; Vector Laboratories, Inc. Burlingame, CA, USA)およびジアミノベンチジンと過酸化水素を基質に用いて発色させ検出した。対照群には一次抗体の代わりに正常ウサギ血清を用いて同様の操作を行った。対比染色は行わなかった。 |
Bell, T. A. and Lightner, D. V. (1988) A Handbook of Normal Penaeid Shrimp Histology. Published by World Aquaculture Society.
Kiernan, J. A. (2003) Histological & Histochemical Methods: Theory & Practice. 3rd ed. Oxford University Press.
Kurokawa, T. and Suzuki, T. (1995) Journal of Fish Biology 46, 292-301.
Kurokawa, T., Suzuki, T., and Andoh, T. (2000) General and Comparative Endocrinology 120, 8-16.
Mizuhira, V. (1990) Electronmicroscopy 25(1), 44-57. (In the Japanese language)


